Mounjaro Prospect
Aici puteti gasit Mounjaro – Prospect.
Acest medicament (Mounjaro) face obiectul unei monitorizări suplimentare. Acest lucru va permite identificarea rapidă de noi informaţii referitoare la siguranţă. Profesioniştii din domeniul sănătăţii sunt rugaţi să raporteze orice reacţii adverse suspectate. Vezi pct. 4.8 pentru modul de raportare a reacţiilor adverse.

- 1. DENUMIREA COMERCIALĂ A MEDICAMENTULUI
- 2. COMPOZIŢIA CALITATIVĂ ŞI CANTITATIVĂ
- 3. FORMA FARMACEUTICĂ
- 4. DATE CLINICE
- 4.1 Indicaţii terapeutice
- 4.2 Doze şi mod de administrare
- 4.3 Contraindicaţii
- 4.4 Atenţionări şi precauţii speciale pentru utilizare
- 4.5 Interacţiuni cu alte medicamente şi alte forme de interacţiune
- 4.6 Fertilitatea, sarcina şi alăptarea
- 4.7 Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilaje
- 4.8 Reacţii adverse
- 4.9 Supradozaj
1. DENUMIREA COMERCIALĂ A MEDICAMENTULUI
Mounjaro 2,5 mg soluţie injectabilă în stilou injector (pen) preumplut
Mounjaro 5 mg soluţie injectabilă în stilou injector (pen) preumplut
Mounjaro 7,5 mg soluţie injectabilă în stilou injector (pen) preumplut
Mounjaro 10 mg soluţie injectabilă în stilou injector (pen) preumplut
Mounjaro 12,5 mg soluţie injectabilă în stilou injector (pen) preumplut
Mounjaro 15 mg soluţie injectabilă în stilou injector (pen) preumplut
2. COMPOZIŢIA CALITATIVĂ ŞI CANTITATIVĂ
Mounjaro 2,5 mg soluţie injectabilă în stilou injector (pen) preumplut
Fiecare stilou injector conţine 2,5 mg de tirzepatidă în 0,5 ml de soluţie.
Mounjaro 5 mg soluţie injectabilă în stilou injector (pen) preumplut
Fiecare stilou injector conţine 5 mg de tirzepatidă în 0,5 ml de soluţie.
Mounjaro 7,5 mg soluţie injectabilă în stilou injector (pen) preumplut
Fiecare stilou injector conţine 7,5 mg de tirzepatidă în 0,5 ml de soluţie.
Mounjaro 10 mg soluţie injectabilă în stilou injector (pen) preumplut
Fiecare stilou injector conţine 10 mg de tirzepatidă în 0,5 ml de soluţie.
Mounjaro 12,5 mg soluţie injectabilă în stilou injector (pen) preumplut
Fiecare stilou injector conţine 12,5 mg de tirzepatidă în 0,5 ml de soluţie.
Mounjaro 15 mg soluţie injectabilă în stilou injector (pen) preumplut
Fiecare stilou injector conţine 15 mg de tirzepatidă în 0,5 ml de soluţie.
Pentru lista tuturor excipienţilor, vezi pct. 6.1.
3. FORMA FARMACEUTICĂ
Soluţie injectabilă.
Soluţie limpede, incoloră până la uşor gălbuie.
4. DATE CLINICE
4.1 Indicaţii terapeutice
Mounjaro este indicat pentru tratamentul diabetului zaharat de tip 2 la adulţi, ca adjuvant la regimul alimentar şi exerciţii fizice
• ca monoterapie, când utilizarea tratamentului cu metformin este considerată inadecvată, din cauza intoleranței sau contraindicaţiilor
• ca terapie adaugată la tratamentul cu alte medicamente hipoglicemiante.
Pentru rezultatele studiului referitoare la asocieri terapeutice, efecte asupra controlului glicemic precum şi grupele de pacienți studiate, vezi pct. 4.4, 4.5 şi 5.1.
4.2 Doze şi mod de administrare
Doze
Doza iniţială de tirzepatidă este de 2,5 mg, o dată pe săptămână. După 4 săptămâni, doza trebuie crescută la 5 mg, o dată pe săptămână. Dacă este necesar, dozele pot fi crescute în trepte de câte 2,5 mg după minimum 4 săptămâni de administrare a dozei curente.
Dozele de întreţinere recomandate sunt de 5, 10 şi 15 mg.
Doza maximă este de 15 mg, o dată pe săptămână.
Atunci când tirzepatida este adăugată tratamentului existent cu metformin şi/sau inhibitor al co- transportorului 2 de sodiu-glucoză (sodium-glucose co-transporter 2 inhibitor, SGLT2i), se poate continua administrarea dozei curente de metformin şi/sau SGLT2i.
Atunci când tirzepatida este adăugată la terapia cu o sulfoniluree şi/sau insulină, poate fi avută în vedere scăderea dozei de sulfoniluree sau insulină, pentru reducerea riscului de hipoglicemie. Auto- monitorizarea glicemiei este necesară pentru ajustarea dozei de sulfoniluree şi insulină. Se recomandă o strategie etapizată de reducere a dozei de insulină (vezi pct. 4.4 şi 4.8).
Doze omise
Dacă se omite o doză, aceasta trebuie administrată cât mai curând posibil, în cel mult 4 zile de la momentul omiterii dozei. Dacă au trecut mai mult de 4 zile, nu se va mai administra doza omisă iar următoarea doză trebuie administrată în ziua programată. În fiecare caz, pacienţii pot ulterior relua schema de administrare uzuală o dată pe săptămână.
Modificarea schemei de administrare
Ziua administrării săptămânale poate fi schimbată, dacă este necesar, atât timp cât intervalul dintre două doze succesive este de cel puţin 3 zile.
Grupe speciale de pacienţi
Vârsta, sexul, rasa, etnia sau greutatea corporală.
Nu este necesară ajustarea dozelor în funcţie de vârstă, sex, rasă, etnie sau greutate corporală (vezi pct. 5.1 şi 5.2).
Insuficienţă renală
Nu este necesară ajustarea dozelor în cazul pacienţilor cu insuficiență renală, inclusiv boală renală în stadiu terminal (BRST). Experienţa utilizării tirzepatidei la pacienţi cu insuficiență renală severă şi BRST este limitată. Se recomandă prudență în tratarea acestor pacienţi cu tirzepatidă (vezi pct. 5.2).
Insuficienţă hepatică
Nu este necesară ajustarea dozelor pentru pacienţii cu insuficienţă hepatică. Experienţa utilizării tirzepatidei la pacienţi cu insuficiență hepatică severă este limitată. Se recomandă prudență în tratarea acestor pacienţi cu tirzepatidă (vezi pct. 5.2).
Copii şi adolescenţi
Siguranţa şi eficacitatea tirzepatidei la copii cu vârsta sub 18 ani nu au fost încă stabilite. Nu sunt disponibile date.
Mod de administrare
Mounjaro se administrează prin injectare subcutanată la nivelul abdomenului, coapsei sau a braţului.
Doza poate fi administrată în orice moment al zilei, cu sau fără alimente.
Locurile de injectare trebuie schimbate prin rotaţie la fiecare doză. Dacă pacientul îşi injectează şi insulină, acesta trebuie să îşi administreze Mounjaro într-un loc de injectare diferit.
Pacienţii trebuie sfătuiţi să citească cu atenţie instrucțiunile de utilizare furnizate împreună cu prospectul înainte de a administra medicamentul.
Pentru informaţii suplimentare înainte de administrare, vezi pct. 6.6.
4.3 Contraindicaţii
Hipersensibilitate la substanţa activă sau la oricare dintre excipienţii enumeraţi la punctul 6.1.
4.4 Atenţionări şi precauţii speciale pentru utilizare
Pancreatită acută
Tirzepatida nu a fost studiată la pacienţi cu pancreatită în antecedente şi trebuie utilizată cu precauţie la aceşti pacienţi.
La pacienţii trataţi cu tirzepatidă au fost raportate cazuri de pancreatită acută.
Pacienţii trebuie informaţi cu privire la simptomele pancreatitei acute. Dacă se suspectează prezenţa pancreatitei, se va întrerupe tratamentul cu tirzepatidă. Dacă se confirmă diagnosticul de pancreatită, tratamentul cu tirzepatidă nu trebuie reluat. În absenţa altor semne şi simptome de pancreatită acută, creşterile valorilor enzimelor pancreatice ca fenomen singular nu reprezintă un predictor al pancreatitei acute (vezi pct. 4.8).
Hipoglicemia
Pacienţii trataţi cu tirzepatidă în asociere cu un secretagog al insulinei (de exemplu, o sulfoniluree) sau cu insulină pot avea risc crescut de apariţie a hipoglicemiei. Riscul de hipoglicemie poate fi redus prin scăderea dozei de secretagog insulinic sau de insulină (vezi pct. 4.2 şi 4.8).
Efecte gastrointestinale
Tirzepatida s-a asociat cu reacţii adverse gastrointestinale, printre care greață, vărsături şi diaree (vezi pct. 4.8). Aceste reacţii adverse pot conduce la deshidratare, care ar putea cauza deteriorarea funcţiei renale, inclusiv insuficiență renală acută. Pacienţii trataţi cu tirzepatidă trebuie informaţi despre riscul potenţial al deshidratării, în special în relaţie cu reacţiile adverse gastrointestinale şi trebuie să ia măsuri de precauţie pentru a evita pierderile de lichide și tulburările electrolitice. Acest lucru trebuie luat în considerare în special la vârstnici, care pot fi mai susceptibili la astfel de complicații.
Boală gastrointestinală severă
Tirzepatida nu a fost studiată la pacienţi cu boală gastrointestinală severă, inclusiv gastropareză severă, şi trebuie utilizată cu precauţie la aceşti pacienţi.
Retinopatie diabetică
Tirzepatida nu a fost studiată la pacienţi cu retinopatie diabetică neproliferativă care necesită terapie acută, retinopatie diabetică proliferativă sau edem macular de etiologie diabetică şi trebuie utilizată cu prudență şi sub monitorizare corespunzătoare la aceşti pacienţi.
Vârstnici
Sunt disponibile doar date foarte limitate de la pacienţii cu vârsta ≥ 85 ani.
Conţinutul de sodiu
Acest medicament conţine sodiu mai puţin de 1 mmol (23 mg) per fiecare doză, adică practic „nu conţine sodiu”.
4.5 Interacţiuni cu alte medicamente şi alte forme de interacţiune
Tirzepatida întârzie evacuarea gastrică şi, astfel, are potenţialul de a influenţa rata de absorbţie a medicamentelor administrate concomitent pe cale orală. Acest efect, care conduce la scăderea Cmax şi la prelungirea tmax, este cel mai pronunţat la momentul iniţierii tratamentului cu tirzepatidă.
Pe baza rezultatelor unui studiu cu paracetamol, care a fost utilizat ca medicament model pentru evaluarea efectului tirzepatidei asupra evacuării gastrice, nu se anticipează necesitatea ajustării dozelor pentru majoritatea medicamentelor administrate concomitent pe cale orală. Cu toate acestea, se recomandă monitorizarea pacienţilor trataţi cu medicamente care se administrează pe cale orală şi care au un indice terapeutic îngust (precum warfarina, digoxina), în special la iniţierea tratamentului cu tirzepatidă şi după creşterea dozei. De asemenea, în cazul medicamentelor cu administrare orală la care producerea rapidă a efectului este importantă, trebuie luat în considerare riscul întârzierii efectului.
Paracetamol
După administrarea unei singure doze de 5 mg de tirzepatidă, concentraţia plasmatică maximă (Cmax) de paracetamol s-a redus cu 50 %, iar tmax median a fost prelungit cu 1 oră. Efectul tirzepatidei asupra absorbţiei paracetamolului administrat pe cale orală este dependent de doză şi timp. La administrarea în doze mici (0,5 şi 1,5 mg), s-a observat doar o modificare minoră a expunerii la paracetamol. După administrarea a patru doze săptămânale consecutive de tirzepatidă (5/5/8/10 mg), nu s-a observat niciun efect asupra Cmax şi tmax ale paracetamolului. Expunerea totală (ASC) nu a fost influenţată. Nu este necesară ajustarea dozei de paracetamol în cazul administrării concomitente cu tirzepatidă.
Contraceptive orale
Administrarea unui contraceptiv oral combinat (0,035 mg de etinilestradiol plus 0,25 mg de norgestimat, un promedicament al norelgestrominului) în prezenţa unei doze unice de tirzepatidă (5 mg) a avut ca rezultat scăderea Cmax şi a ariei de sub curba concentrației plasmatice în funcție de timp (ASC) pentru contraceptivul oral. Cmax a etinilestradiolului a scăzut cu 59 % şi ASC cu 20 %, iar tmax a fost prelungit cu 4 ore. Cmax a norelgestrominului a scăzut cu 55 % şi ASC cu 23 %, iar tmax a fost prelungit cu 4,5 ore. Cmax a norgestimatului a scăzut cu 66 % şi ASC cu 20 %, iar tmax a fost prelungit cu 2,5 ore. Această reducere a expunerii după o doză unică de tirzepatidă nu este considerată relevantă din punct de vedere clinic. Nu este necesară ajustarea dozelor contraceptivelor orale.
4.6 Fertilitatea, sarcina şi alăptarea
Sarcină
Datele provenite din utilizarea tirzepatidei la femeile gravide sunt limitate sau inexistente. Studiile la animale au evidenţiat efecte toxice asupra funcţiei de reproducere (vezi pct. 5.3). Tratamentul cu tirzepatidă nu este recomandat în timpul sarcinii și la femeile aflate la vârsta fertilă care nu utilizează metode contraceptive.
Alăptarea
Nu se cunoaşte dacă tirzepatida se excretă în laptele matern. Nu se poate exclude un risc pentru nou-născuţi/sugari.
Trebuie luată decizia fie de a întrerupe alăptarea, fie de a întrerupe/a se abţine de la tratamentul cu tirzepatidă, având în vedere beneficiul alăptării pentru copil şi beneficiul tratamentului pentru femeie.
Fertilitate
Nu se cunoaşte efectul tirzepatidei asupra fertilităţii la om.
Studiile la animale nu au evidenţiat efecte dăunătoare directe asupra fertilităţii (vezi pct. 5.3).
4.7 Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilaje
Tirzepatida nu are nicio influenţă sau are influenţă neglijabilă asupra capacităţii de a conduce vehicule sau de a folosi utilaje. În cazul utilizării tirzepatidei în asociere cu o sulfoniluree sau cu insulină, pacienţii trebuie sfătuiţi să ia măsuri de precauţie în vederea evitării hipoglicemiei atunci când conduc vehicule sau folosesc utilaje (vezi pct. 4.4).
4.8 Reacţii adverse
Rezumatul profilului de siguranţă
În 7 studii de fază 3 finalizate, 5119 de pacienţi au fost expuşi la tirzepatidă în monoterapie sau în asociere cu alte medicamente hopoglicemiante. Reacţiile adverse raportate cel mai frecvent au fost tulburările gastrointestinale, printre care greaţa (foarte frecvent), diareea (foarte frecvent) şi vărsăturile (frecvent). În general, aceste reacţii au fost, în majoritate, uşoare sau moderate ca severitate şi au survenit cel mai adesea în perioada de creştere a dozei, ulterior diminuându-se în timp (vezi pct. 4.2 şi 4.4).
Lista reacţiilor adverse sub formă de tabel
Următoarele reacții adverse asociate tratamentului, observate în studiile clinice, sunt enumerate mai jos pe aparate, sisteme și organe și în ordinea descrescătoare a incidenței (foarte frecvente: ≥ 1/10; frecvente: ≥1/100 şi <1/10; mai puţin frecvente: ≥1/1000 şi <1/100; rare: ≥1/10 000 şi <1/ 1000; foarte rare: < 1/10 000). În cadrul fiecărei categorii, reacţiile adverse sunt prezentate în ordinea descrescătoare a frecvenţei.
Tabelul 1. Reacţii adverse
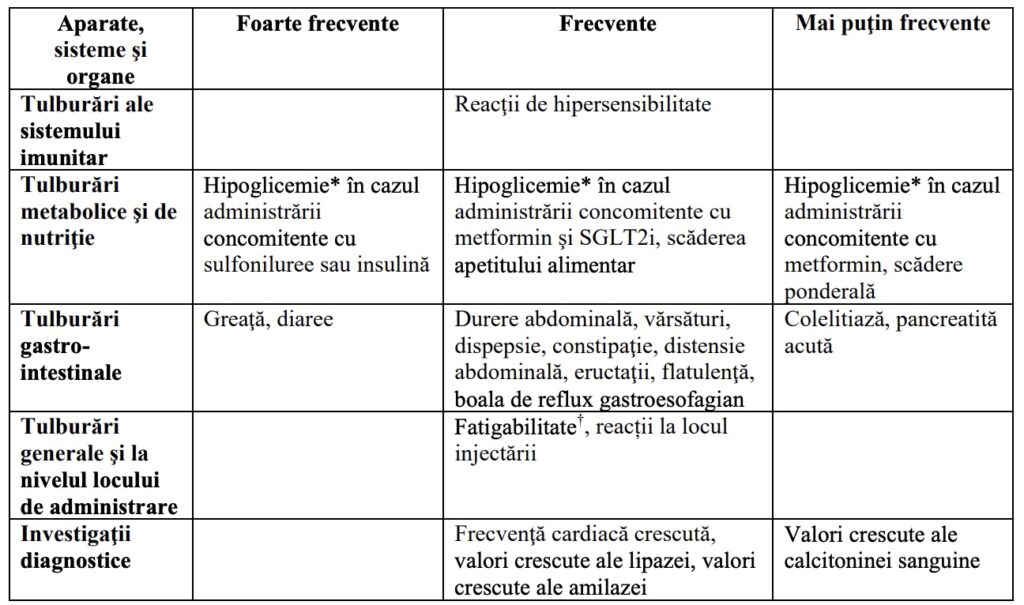
*Hipoglicemie conform definiţiei de mai jos.
† Fatigabilitatea include termenii fatigabilitate, astenie, maleză şi letargie.
Descrierea reacţiilor adverse selectate
Reacţii de hipersensibilitate
La nivelul populaţiei cumulate din studiile clinice controlate cu placebo au fost raportate reacţii de hipersensibilitate asociate cu administrarea tirzepatidei, unele dintre acestea severe (de exemplu, urticarie şi eczemă); reacţiile de hipersensibilitate au fost raportate la 3,2 % dintre pacienţii trataţi cu tirzepatidă, comparativ cu 1,7 % dintre pacienţii la care s-a administrat placebo.
Hipoglicemia
Hipoglicemia semnificativă clinic (valori ale glicemiei < 3,0 mmol/l (< 54 mg/dl) sau hipoglicemie severă (necesitând asistenţă din partea unei alte persoane)) a apărut la 10 până la 14 % (0,14 până la 0,16 evenimente/pacient-an) dintre pacienţi atunci când s-a adăugat tirzepatidă la sulfoniluree şi la 14 până la 19 % (0,43 până 0,64 evenimente/pacient-an) dintre pacienţi atunci când tirzepatida a fost adăugată terapiei cu insulină bazală.
Rata de incidenţă a hipoglicemiei semnificative clinic atunci când tirzepatida a fost utilizată în monoterapie sau atunci când a fost adăugată altor medicamente antidiabetice cu administrare orală a fost de până la 0,04 evenimente/pacient-an (vezi tabelul 1 şi pct. 4.2, 4.4 şi 5.1).
În studiile clinice de fază 3, 10 (0,2 %) pacienţi au raportat 12 episoade de hipoglicemie severă. Dintre aceşti 10 pacienţi, 5 (0,1 %) urmau un tratament de fond cu insulină glargin sau cu o sulfoniluree şi au raportat câte 1 episod de hipoglicemie.
Reacţiile adverse gastrointestinale
În studiile de fază 3 controlate cu placebo, frecvenţa tulburărilor gastrointestinale a crescut dependent de doză în cazul administrării dozelor de tirzepatidă 5 mg (37,1 %), 10 mg (39,6 %) şi 15 mg (43,6 %), comparativ cu placebo (20,4 %). Greaţa a fost înregistrată la 12,2 %, 15,4 % şi 18,3 % dintre pacienţi, comparativ cu 4,3 %, iar diareea la 11,8 %, 13,3 % şi 16,2 %, comparativ cu 8,9 % dintre pacienţi atunci când s-a administrat tirzepatidă în doze de 5 mg, 10 mg şi, respectiv, 15 mg comparativ cu placebo. Reacţiile adverse gastrointestinale au fost, în majoritate, uşoare (74 %) sau moderate (23,3 %) ca severitate. Incidenţa stărilor de greaţă, vărsăturilor şi diareii a fost mai mare în perioada de creştere a dozei şi s-a diminuat în timp.
Mai mulţi subiecţi din grupurile tratate cu tirzepatidă în doză de 5 mg (3,0 %), 10 mg (5,4 %) şi 15 mg (6,6 %) decât din grupul cu administrare de placebo (0,4 %) au întrerupt definitiv tratamentul din cauza evenimentului gastrointestinal.
Imunogenitatea
În studiile clinice de fază 3 au fost evaluaţi 5025 de pacienţi trataţi cu tirzepatidă pentru prezenţa anticorpilor anti-medicament (AAM). Dintre aceştia, 51,1 % au dezvoltat ADA induşi de tratament (IT) în perioada în care au administrat tratamentul. La 38,3 % dintre pacienţii evaluaţi, AAM IT au fost persistenţi (prezenţi pe o perioadă de 16 săptămâni sau mai lungă). La 1,9 % şi 2,1 % au fost detectaţi anticorpi neutralizanţi împotriva activităţii tirzepatidei pe receptorii polipeptidului insulinotrop dependent de glucoză (glucose-dependent insulinotropic polypeptide, GIP) şi, respectiv, ai peptidului 1 glucagon-like (glucagon-like peptide-1, GLP-1), şi 0,9 % şi 0,4 % prezentau anticorpi neutralizanţi împotriva peptidelor native GIP şi, respectiv, GLP-1. Nu au existat dovezi ale modificării profilului farmacocinetic sau ale vreunui impact asupra eficacităţii şi siguranței tirzepatidei în asociere cu apariţia AAM.
Frecvenţa cardiacă
În studiile de fază 3 controlate cu placebo, tratamentul cu tirzepatidă s-a corelat cu o creştere medie maximă a frecvenţei cardiace de la 3 la 5 bătăi pe minut. Creşterea maximă a frecvenţei cardiace la pacienţii la care s-a administrat placebo a fost, în medie, de 1 bătaie pe minut.
Incidenţa cazurilor de apariţie a unei modificări de > 20 bpm a frecvenţei cardiace iniţiale la 2 sau mai multe vizite consecutive a fost de 2,1 %, 3,8 % şi 2,9 %, în cazul administrării dozelor de tirzepatidă de 5 mg, 10 mg şi, respectiv, 15 mg, comparativ cu 2,1 % pentru placebo.
Au fost observate creșteri medii minore ale intervalului PR în cazul administrării de tirzepatidă, în comparație cu placebo (creștere medie de 1,4 până la 3,2 msec și, respectiv, scădere medie de 1,4 msec). Nu s-au observat diferențe în ceea ce privește evenimentele de aritmie și tulburări de conducere cardiacă induse de tratament în cazul administrării de tirzepatidă în doze de 5 mg, 10 mg, 15 mg, comparativ cu administrarea de placebo (3,8 %, 2,1 %, 3,7 % și, respectiv, 3 %).
Reacţii la locul injectării
În studiile de fază 3 controlate cu placebo, reacţiile la locul injectării au avut o frecvenţă mai mare în grupul de tratament cu tirzepatidă (3,2 %), decât în cel cu administrare de placebo (0,4 %).
În total, în studiile de fază 3, cele mai frecvente semne şi simptome ale reacţiilor la locul injectării au fost eritemul şi pruritul. Gradul de severitate maxim al reacţiilor la locul injectării a fost uşor (90 %) sau moderat (10 %). Niciuna dintre reacţiile la locul injectării nu a fost gravă.
Enzimele pancreatice
În studiile de fază 3 controlate cu placebo, tratamentul cu tirzepatidă a generat creşteri medii ale amilazei pancreatice de 33 % până la 38 % faţă de valorile iniţiale şi creşteri de 31 % până la 42 % ale valorilor lipazei. Pacienţii la care s-a administrat placebo au prezentat creşteri de 4 % ale valorilor amilazei, faţă de valorile iniţiale şi nu au prezentat creşteri ale valorilor lipazei.
Raportarea reacţiilor adverse suspectate
Raportarea reacțiilor adverse suspectate după autorizarea medicamentului este importantă. Acest lucru permite monitorizarea continuă a raportului beneficiu/risc al medicamentului. Profesioniștii din domeniul sănătății sunt rugați să raporteze orice reacție adversă suspectată prin intermediul sistemului național de raportare, astfel cum este menționat în Anexa V.
4.9 Supradozaj
În eventualitatea unui supradozaj, trebuie iniţiat tratamentul de susţinere adecvat pe baza semnelor şi simptomelor clinice ale pacientului. Pacienţii pot avea reacţii adverse gastrointestinale, cum ar fi greaţa. Nu există un antidot specific pentru supradozajul cu tirzepatidă. Poate fi necesară o perioadă de observaţie şi tratament, având în vedere timpul de jumătăţire a tirzepatidei (de aproximativ 5 zile).
Descarca Mounjaro Prospect
Descarcati intreg prospectul Mounjaro AICI.
Gasiti alte propecte aici.